Axonkäglan / axon hillock ej längre där man anser att ursprunget till aktionspotentialen är. Nu har man kommit fram till att det är vid initialsegmentet. Där är de spänningsberoende kanalerna extra koncentrerade. De är en population av spänningsberoende kanaler vilket innebär att några kommer att reagera på volt i det lägre intervallet. Koncentrationen av spänningsberoende kanaler här gör alltså så att tröskelvärdet är som lägst i initialsegmentet.
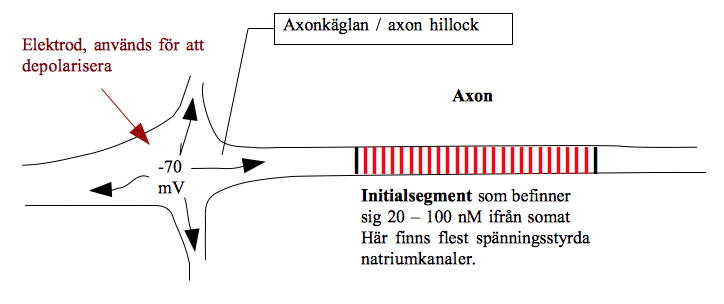
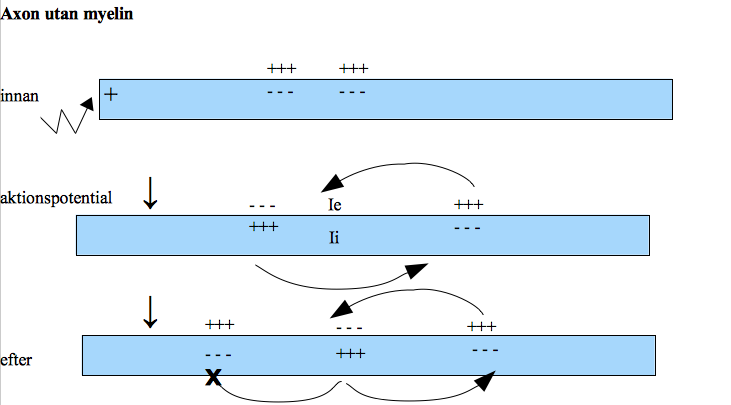 När en positiv ström skickas in i axonet så sprider den sig ut i cellen och i axonet, om det når tröskelvärdet så kommer en aktionspotential att uppstå någonstans i initialsegmentet. I nästa skede kommer det segment där aktionspotentialen uppstår att depolariseras och laddningsfördelningen blir för en kort stund omvänd/reverserad, alltså positivt på insidan och negativt på utsidan av axonets membran. Framförvarande segment har först normal membranpotential, innan aktionspotentialen har hunnit sprida sig. Men då spänningsberoende kanaler aktiverats sker ett inflöde av positiva natriumjoner in i axonet = en positiv ström. Strömmen kommer flyta inne i axonet, en intracellulär ström som sprider sig framåt. Men vi får också en extracellulär ström som kommer sprida sig på utsidan av axonet. Strömmen kommer flyta i en krets. Ström vill alltid flyta i en sluten krets om den kan. Vid nästa tidpunkt har vi nu en positiv insida i nästa segmentet eftersom den positiva strömmen har färdats framåt, men i det segment aktionspotential nyss befann sig är det nu repolariserat. Membranpotentialen är där tillbaka till -70mV. En aktionspotential uppkommer alltså i ett segment och sprids framåt i axonet, steg för steg. Det är hela tiden beroende av att nästa segment också depolariseras genom inflödet av positiva natriumjoner via spänningsstyrda kanaler.
När en positiv ström skickas in i axonet så sprider den sig ut i cellen och i axonet, om det når tröskelvärdet så kommer en aktionspotential att uppstå någonstans i initialsegmentet. I nästa skede kommer det segment där aktionspotentialen uppstår att depolariseras och laddningsfördelningen blir för en kort stund omvänd/reverserad, alltså positivt på insidan och negativt på utsidan av axonets membran. Framförvarande segment har först normal membranpotential, innan aktionspotentialen har hunnit sprida sig. Men då spänningsberoende kanaler aktiverats sker ett inflöde av positiva natriumjoner in i axonet = en positiv ström. Strömmen kommer flyta inne i axonet, en intracellulär ström som sprider sig framåt. Men vi får också en extracellulär ström som kommer sprida sig på utsidan av axonet. Strömmen kommer flyta i en krets. Ström vill alltid flyta i en sluten krets om den kan. Vid nästa tidpunkt har vi nu en positiv insida i nästa segmentet eftersom den positiva strömmen har färdats framåt, men i det segment aktionspotential nyss befann sig är det nu repolariserat. Membranpotentialen är där tillbaka till -70mV. En aktionspotential uppkommer alltså i ett segment och sprids framåt i axonet, steg för steg. Det är hela tiden beroende av att nästa segment också depolariseras genom inflödet av positiva natriumjoner via spänningsstyrda kanaler.
Strömmen kan inte färdas bakåt i ett segment som precis varit aktiverat av en aktionspotential. Det beror på att det tidigare segmentets spänningsberoende kanaler är inaktiverade. Det går inte att få någon ny aktionspotential i det segmentet förrän de spänningsberoende kanalerna återgått till sitt vilostadie. Perioden när de spänningsberoende kanalerna återgår till ett stadie där de kan aktiveras av en ny aktionspotential delas in i två faser. Absolut refraktärperiod innebär att i princip alla spänningskanaler är inaktiverade i den populationen i det segmentet. Relativ refraktärperiod innebär att vissa kanaler har gått tillbaka till sitt vilostadie/”resting state”. Några av dem kan alltså aktiveras igen, men eftersom att alla inte är redo att aktiveras igen av en ny aktionspotential blir tröskelvärdet för en ny aktionspotential under den relativa refraktärperioden högre. När de spänningsberoende kanalerna återgått till sitt vilostadie återgår också aktionspotentialen till sitt ursprungliga tröskelvärde.
Strömmen i en axon kan i princip inte färdas bakåt, men precis i ursprungsläget där aktionspotentialen initialt uppstår finns det ju ännu ingen tidigare aktiverad sekvens som ligger bakom/innan den. Där har därför inte de spänningsaktiverade portarna stängts och en liten ström kan därför potentiellt färdas bakåt. Detta kallas för en bakåtpropagerande aktionspotential. Det verkar som om det inte fyller någon funktion, då ju strömmen syftar till att färdas framåt, mot en axonterminal för att förmedla information till nästa cell. Men att strömmen också färdas bakåt mot neuronens soma tror man idag bidrar till att öka dendriternas excitabilitet. Om man depolariserar dendriterna så kan det öka effekten av den synaptiska input som den får från andra celler.
Då förloppet med aktionspotentialer illustreras kan det se ut som om vi har en stor mängd natriumjoner som ”springer framåt” och rusar hela vägen längst axonet. Men så är det inte, rörelsen där aktionspotentialen sprids framåt kan beskrivas som ”en knackade rörelse” som för depolariseringen framåt. Det finns en mängd joner inne i axonen som för strömmen framåt. De ”puffar på grannen” så att säga.
En myelintäckt axon
Myelin består av fett, vatten och protein och produceras i PNS av Schwannceller och i CNS av oligodendrocyter.
1. Myelin isolerar axon och gör att ledningshastigheten ökar.
Rm↑ R = resistansen m = membran
Myelin ökar resistansen över membranet, det kan liknas vid en läckande slang som tejpas för att minska läckaget. Läckaget beror på de olika jonkanalerna. Myelin tätar alltså axonet genom att täta jonkanalerna så att ström inte kan läcka ut. Axonet kan då mer effektivt depolarisera framförvarande segment.
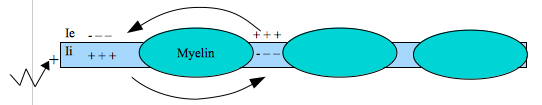 Området mellan myelinet kallas Ranvierska noder. Där finns det många spänningskänsliga kanaler. Under myelinet finns det däremot nästan inga. Strömmen kommer räcka ända till nästan nod utan att dö ut. I en myelintäckt axon kommer alltså strömmen att kunna färdas längre sträckor i taget och kunna depolarisera axonet hela vägen till nästa nod. Strömmen kan alltså räcka längre i myelintäckta axon skulle man kunna säga.
Området mellan myelinet kallas Ranvierska noder. Där finns det många spänningskänsliga kanaler. Under myelinet finns det däremot nästan inga. Strömmen kommer räcka ända till nästan nod utan att dö ut. I en myelintäckt axon kommer alltså strömmen att kunna färdas längre sträckor i taget och kunna depolarisera axonet hela vägen till nästa nod. Strömmen kan alltså räcka längre i myelintäckta axon skulle man kunna säga.
2. Nästa effekt av myelinet är minskad kapacitans = förmåga att lagra laddningar. Myelin minskar axonets membrankapacitans.
Cm↓ C = kapacitans m = membran
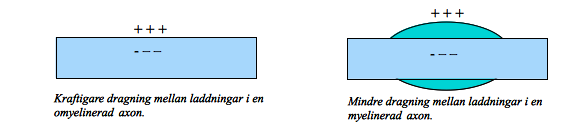 Myelinet gör att det blir längre mellan spänningarna och de dras därför inte lika hårt mot varandra. Spänningarna i det elektriska fältet har minskat i styrka genom att myelinet separerar laddningarna på axonen in- och utsida. En aktionspotential kan alltså snabbare färdas i en myelinerad axon. Natriumströmmen som kommer in i ett myelintäckt axon kan snabbare ändra membranpotentialen i framförvarande segment. När vi får in natriumjoner/positiv ström så finns det mindre negativa laddningar vid membranytan att konkurrera med. Det går snabbare för Na+ att konkurrera ut de negativa laddningarna och färdas framåt och depolarisera nästa segment vid nästa nod.
Myelinet gör att det blir längre mellan spänningarna och de dras därför inte lika hårt mot varandra. Spänningarna i det elektriska fältet har minskat i styrka genom att myelinet separerar laddningarna på axonen in- och utsida. En aktionspotential kan alltså snabbare färdas i en myelinerad axon. Natriumströmmen som kommer in i ett myelintäckt axon kan snabbare ändra membranpotentialen i framförvarande segment. När vi får in natriumjoner/positiv ström så finns det mindre negativa laddningar vid membranytan att konkurrera med. Det går snabbare för Na+ att konkurrera ut de negativa laddningarna och färdas framåt och depolarisera nästa segment vid nästa nod.
Ledningshastighet i ett axon påverkas av:
Myelin (se ovan)DiameterTemperatur
När diametern är större på axonet ökar dess ledningshastighet. Det beror på att resistansen minskar. Det finns då fler laddningsbärare per axonsegment som kan bära strömmen framåt. Ri↓ Intracellulär resistans sjunker. Resistensen inne i axonet (inte över membranet). Effekten av minskad resistans och myelin kan kombineras och ger då ökad snabbhet.
 Temperaturer påverkar, ledningshastigheten är optimal vid 37 grader. Det beror på att spänningskänsliga natriumkanaler beter sig som enzymer och är känslig för temperaturer. Deras gater är känsliga för temperatur med tanke på hur dess gater öppnas och stängs. Vid 37 grader så är det optimerat för att så många Na+ joner som möjligt ska kunna kan ta sig igenom kanalen medan den är öppen. Vid lägre temperatur så kommer aktiveringsgaten att öppnas långsammare, även om inaktiveringsgaten stänger långsammare också, så kommer ändå nettot att bli att färre joner kommer igenom. Vid en högre temperatur så kommer inaktiveringsgaten att stänga tidigare och färre natriumjoner kommer att kunna passera igenom innan stängning.
Temperaturer påverkar, ledningshastigheten är optimal vid 37 grader. Det beror på att spänningskänsliga natriumkanaler beter sig som enzymer och är känslig för temperaturer. Deras gater är känsliga för temperatur med tanke på hur dess gater öppnas och stängs. Vid 37 grader så är det optimerat för att så många Na+ joner som möjligt ska kunna kan ta sig igenom kanalen medan den är öppen. Vid lägre temperatur så kommer aktiveringsgaten att öppnas långsammare, även om inaktiveringsgaten stänger långsammare också, så kommer ändå nettot att bli att färre joner kommer igenom. Vid en högre temperatur så kommer inaktiveringsgaten att stänga tidigare och färre natriumjoner kommer att kunna passera igenom innan stängning.
Vad händer när aktionspotentialen når axonterminalerna?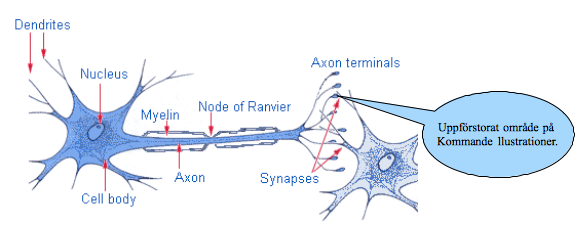 Vad är det som bestämmer vad det är för typ av synaps? Det beror på vilken typ av transmittorsubstans som används i presynapsen och vilka receptorer som finns på postsynapsen.
Vad är det som bestämmer vad det är för typ av synaps? Det beror på vilken typ av transmittorsubstans som används i presynapsen och vilka receptorer som finns på postsynapsen.
Synaptiska vesiklar är fyllda med transmittorsubstans. Endosomen är en organell som fungerar som återvinningscentral för synaptiska vesiklar.
Presynaps = sändande cellPostsynaps = mottagande cell Fil:IllustrationsynapserA.jpg Glutamatsynapser och GABA-synapser Det finns flera faktorer som är gemensamma för glutamatsynapser (excitatoriska, pyramid) och GABA-synapser (inhibitoriska, interneuron). Många saker i det neurotransmittoriska maskineriet är gemensamma.
I neuronen så sker följande steg för att neurotransmittorsubstans ska kunna frisättas. Detta gäller båda typerna av synapser.
- Vesiklar knoppas av av endosomen och får en proteinhölje av Clathrin. Clathrin fungerar som kompass och talar om vart vesikeln ska ta vägen.
- Nästa steg är att vesikeln dockar vid det presynaptiska membranet och fylls med neurotransmittorsubstans. I detta fall kan det vara glutamat eller GABA.
- Ett protein binder vesiklarna samman när de väntar på att färdas vidare. Det proteinet kallas synapsin.
- Sedan transporteras vesikeln ner mot membranet som vetter mot den postsynaptiska cellen. Där hålls den nära membranet av samma protein; synapsin.
Om vi förstorar en synaptisk vesikel så kan vi titta närmare på några protein som är viktiga. De finns i den synaptiska vesikelns membran och i membranet i själva presynapsen.
Protein:
- Synaptobrevin
- Synaptotagmin
Sedan har vi protein i membranet i själva presynapsen.
Protein:
- SNAP 25
- Syntaxin
Dessa 4 protein utgör tillsammans ett komplex som kallas SNARE-proteiner För att den presynaptiska vesikeln som har närmat sig det presynaptiska membranet ska kunna primas behöver den bindas till det presynaptiska membranet med hjälp av proteinerna. Under själva primningen binder vesikeln till membranet med hjälp av protinerna och då bidas det som kallas ett SNARE-komplex. Randy Schekman, James Rothman och Thomas Südhof fick Nobelpriset i fysiologi eller medicin 2013 för sina upptäckter om mekanismerna kring SNARE-medierad exocytos.
- Nästa steg innebär att den synaptiska vesikeln ska frisätta sitt innehåll. Det kallas för fusion.
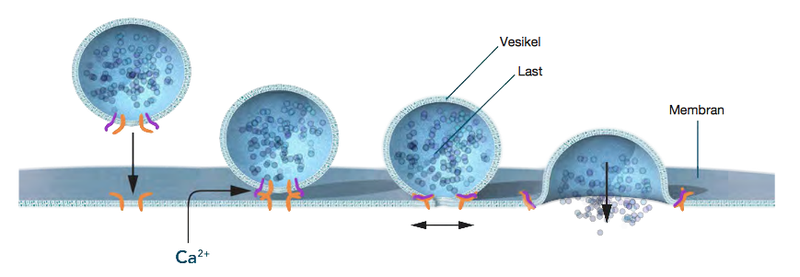 För att fusion ska kunna fungera så krävs det att något viktigt händer. I det presynaptiska membranet finns kanaler, de är spänningskänsliga Ca'2+'-kanaler.
För att fusion ska kunna fungera så krävs det att något viktigt händer. I det presynaptiska membranet finns kanaler, de är spänningskänsliga Ca'2+'-kanaler.
Vad händer när vi får en aktionspotential som propagerar längs med axonet till en presynaptisk terminal?
Spänningsskillnaden aktiverar de spänningskänsliga Ca2+-kanalerna. På insidan av en cell finns det lite Ca2+ och det fungerar som en intracellulär messenger. Om nivån vore hög intracellulärt så skulle inte de inte fungera som budbärare. Därför kan en dra slutsatsen att det finns mest kalcium utanför cellen. När en spänningskänslig Ca2+-kanal öppnas kommer alltså Ca2+ att strömma in.
- Nära membranet har vi en primad vesikel, den är alltså redo att frisättas. Ca'2+' binder till synaptotagmin (synaptotagmin är alltså ett kalciumbindande protein) och en konformationsändring initieras.
- Proteinets struktur ändras, vilket i sin tur leder till att synaptotagminet tar tag i det presynaptiska membranet och vränger vesikeln in och ut.
- Det leder till att vesikelns innehåll sammansluts med membranets. Då kan transmittorsubstans frisättas ut i det område som kallas synapsklyftan.
- I nästa steg så sker ett återupptag av den tomma vesikelmembranytan. Den återupptas av den presynaptiska terminalen och får ett nytt cathedrinhölje, som talar om för den att den ska tillbaka till endosomen och återvinnas.
Vad påverkas sannolikheten att det ska ske en frisättning av transmittorsubstans?Alla aktionspotentialer leder inte till frisättning av transmittorsubstanser, det är bara ungefär en av tio gör det. Till att börja med sker ingen frisättning om det inte finns en primad vesikel. Det andra som är viktigt är flödet av Ca2+. Mängden av Ca2+ som kommer in i presynapsen är direkt relaterat till sannolikheten att det blir transmittorfrisättning. Ca2+ är inte viktigt för membranets potential, men avgörande för frisättning av transmittorsubstanser.
Skillnader i Glutamatsynapser och GABA-synapser
Pyramidceller skapar glutamatsynapser på mottagarcellen och interneuron bildar GABA-synapser på mottagarceller. Men faktum är att båda typerna tar emot både glutamat- och GABA-synapser från andra celler. En pyramidceller kan alltså ha alltså kontakt med annan pyramidceller och ta emot glutamat och även en interneuron kan ha kontakt med samma pyramidcell men då med en GABA-synaps.
Glutamatsynapser är fler än GABA.
I respektive pre-synaptisk finns det specifika transportörer i vesikelmembranet som är ansvariga för att fylla vesikeln med antingen GABA eller glutamat.
Glutamat Efter att en eller flera aktionspotential har triggat frisättning av GABA eller glutamat så frisätts transmittorsubstansen och diffunderar ut i synapsklyftan. I postsynapsen behöver det då finnas receptorer för att signalen ska kunna överföras mellan neuronerna. Vad det gäller glutamat så finns det två typer av receptorer. De heter AMPA och NMDA.
När glutamat binder in så kan jonkanaler öppnas. Det är en ligandstyrda jonkanaler och i detta fall är det glutamat som är liganden. AMPA och NMDA är alltså ligandstyrda jonkanaler. NMDA är permeabel för flera sorters joner. Na+, K+ och Ca2+ kan alla gå genom denna typ av kanal. Na+ kommer gå in K+ ut och Ca2+ in. Vilken typ av polarisering sker? Två positiva in och en positiv ut. På samma sätt som en läck-kanaler (som bara har en typ av jonpermeabilitet) har en jämviktspotential så har dessa ligandstyrda kanaler en reverseringspotential.
Vid reverseringspotentialen så sker ett netto 0 flöde av laddning i kanalen, fast det handlar om flera jonslag. När den beräknas så får en ta hänsyn till att kanalen inte är lika permeabel för all jonslag. Na+, K+ och Ca2+ kanalen är mer permeabel för natriumjoner än kaliumjoner. Det innebär att den jämviktspotential som natrium har kommer att få mer inflytande över reverseringspotentialen än vad kalium får. Värdet kommer att hamna runt 0 mV. Kalciumflödet är i princip oviktigt för värdet på membranpotentialen och påverkar därför inte nämnvärt reverseringspotentialen.
Eftersom reverseringspotentialen i detta fall ligger runt 0 mV sker vid 0 mV inget nettoflöde. Men en neuron har ju ett värde på -70 mV vid normal vilomembranpotential. Det innebär att det vid öppna kanaler finns det en drivkraft som kommer att sträva efter att ta membranpotentialen mot 0 = depolarisering.
GABA GABA-synapser, där finns bara en ligandstyrd jonkanal som kallas GABAA-receptor. När GABA binder in som ligand så öppnas kanalen. Om en tänker att Glutamat är gas så är GABA är broms. Då är det logiskt att membranet depolariserar för att det ska bli en excitatorisk signal. I detta fall borde det alltså bli tvärt om, membranets laddning borde bli ännu mer negativ för att det ska krävas kraftigare aktiveringssignal för att nå tröskelvärdet. Kanalen är permeabel för Cl- och bikarbonat HCO3-, men huvudsakligen för Cl-. Cl- har jämviktspotential på runt -70 mV och reverseringspotentialen kommer att hamna på -60 mV för GABAA-receptorn. Potentialen förskjuts alltså till något mer depolariserat om Cl- jämviktspotential (eftersom det finns en viss permeabilitet för bikarbonat som har en mer positivt jämviktspotential som också påverkar potentialen).
Vid en frisättning och inbindning av GABA till GABAA kommer ligandstyrda kanaler att öppnas. Då kommer Cl- att flöda för att försöka ta membranpotentialen till -60 mV. Om då postsynapsen har ett värde på – 70 mV så kommer det att ske en viss depolarisering, som vid glutamat, GABA kan alltså också depolarisera, men bara till – 60 mV. Om membranpotentialen i postsynapsen i stället hamnar på exempelvis – 20 mV efter att den ha fått en aktiverande impuls så kommer GABA att verka inhiberande. Kanalen kommer att sträva efter att nå ett värde på runt -60 mV och ta tillbaka membranet till nära vilomembranpotentialen. På detta sätt kan GABA bromsa, om en depolarisering håller på att sprida sig i en neuron så kan GABA kortsluta den. En inhibitatorisk synaps kan frisätta GABA på vägen, som då på ett visst ställe kan föra tillbaka membranpotentialen till nära vilomembranpotentialen.
GABA kan alltså på detta sätt styra vilket output som kommer från neuronen. De reglerar vad som når axonterminalerna.
I membranen på båda typerna av celler finns metabotropa receptorer. De är g-protein medierade receptorer. De aktiveras av GABA och Glutamat och även av acetylkollin m.m. De kan binda till exempel överflödigt glutamat från en frisättning (likaså GABA) i detta fall. Då kan en signalväg som exempelvis leder till en sänkning av frisättningssannolikheten initieras. Men signalvägen kan också resultera i en ökad frisättningssannolikhet. Det är en typ av "feed-back-system".
Både nära till glutamat och GABA-synapser finns kontakter med astrocyter som tar upp överbliven transmittor och omvandlar det till en annan substans som sedan skickas tillbaka till den presynaptiska terminalen. Det är en av de stödfunktioner som astrocyter har.
Plasticitet Plasticitet är aktivitetsberoende förändringar i excitabilitet. Beroende på hur en nervcell eller synaps varit aktiverad inom loppet av sekunder eller timmar så kan excitabiliteten förändras beroende på den tidigare aktiviteten.
Långtidsplasticitet Neuralt korrelat av minne, en synaptiskt minnesbildning, en molekylär mekanism. Detta fall gäller det en glutamatsynaps och AMPA och NMDA. NMDA-receptorerna är viktiga här. I experiment har en använt sig av hjärnskivor (råtta, mus). Där sitter pyramidceller i lager. Pyramidcellerna skickar signaler till andra pyramidceller till dendriterna i det område som undersöks (CA1). När en ström/excitatorisk signal induceras uppkommer en aktionspotential. En summering av det synaptiska svar som fås kallas för en excitatorisk postsynaptisk potential. Det är en summering av aktiviteten i ett stort antal glutamatreceptorer. Vid ökad kortvarig högfrekevent stimulering av nervfibrerna blir det en hög aktivitet. Det synaptiska svaret/potentialen ökar. Först radikalt, men sedan något mindre. Men nivån kommer att var högre efter experimentet. Denna långtidsplasticitet beror på kalciumflödet genom NMDA-receptorerna. Ett starkt kalciuminflödet leder till att fler AMPA receptorer färdas från ursprungsläget till postsynapsens membran. Det ger ett starkare svar eftersom det finns fler receptorer som kan svara på signalen.
Normalt så sitter det en magnesiumjon i kanalen. Den flyttar på sig vid en liten depolarisering. Två kriterier måste alltså uppnås för att vi ska få in Ca+ genom en NMDA-receptor. Presynaptisk frisättning och en viss depolarisering av postsynapsen. Detta innebär att nervceller kan detektera när det finns aktivitet i post- och presynaps. NMDA-receptorn är alltså viktig för att detektera när två nervceller är aktiva samtidigt. Om nervfibern i stället stimuleras med en kortare frekvens mer sällan så uppstår en motsatt läge. Det kallas LTD = långtidsdepression det ger ett begränsat inflöde av kalcium och AMPA receptorer försvinner från det postsynaptiska membranet.

